Avis du pôle scientifique Médiamphi
Pastille grise
Pastille grise
Une revue narrative n’a pas de méthodologie standardisée et ne peut donc pas être évaluée sur sa qualité méthodologique avec des grilles de lecture standards. Les résultats sont à prendre avec précautions, sous forme d’hypothèses, à valider par des études à faible risque de biais dont le design est adapté à la question de recherche.
Épidémiologie
Jusqu’à 75% des ECS sont causés par une fracture (fracture de la diaphyse tibiale 36%, fracture de l’avant-bras 9%). On pense souvent que les fractures ouvertes offrent un espace supplémentaire pour l’expansion des tissus, réduisant ainsi le risque d’ECS. Cependant, des études ont montré qu’il n’y a pas de différence en termes de pression intramusculaire (IMP - Intramuscular Pressure) ou de risque de développer un ECS entre les fractures fermées et ouvertes. L’ECS peut également avoir des causes iatrogéniques : compression à long terme d’un membre, injection d’une substance chimique, syndrome d'écrasement, hémorragie spontanée chez un hémophile, un enclouage intramédullaire… Des efforts musculaires répétés peuvent également conduire à une version chronique de l’ECS.
Ce syndrome survient jusqu'à dix fois plus souvent chez les hommes que chez les femmes, probablement en raison d'une masse musculaire plus importante. Le risque est également plus élevé chez les patients ayant subi des blessures à haute énergie avec une fracture ou une lésion des tissus mous.
Physiopathologie
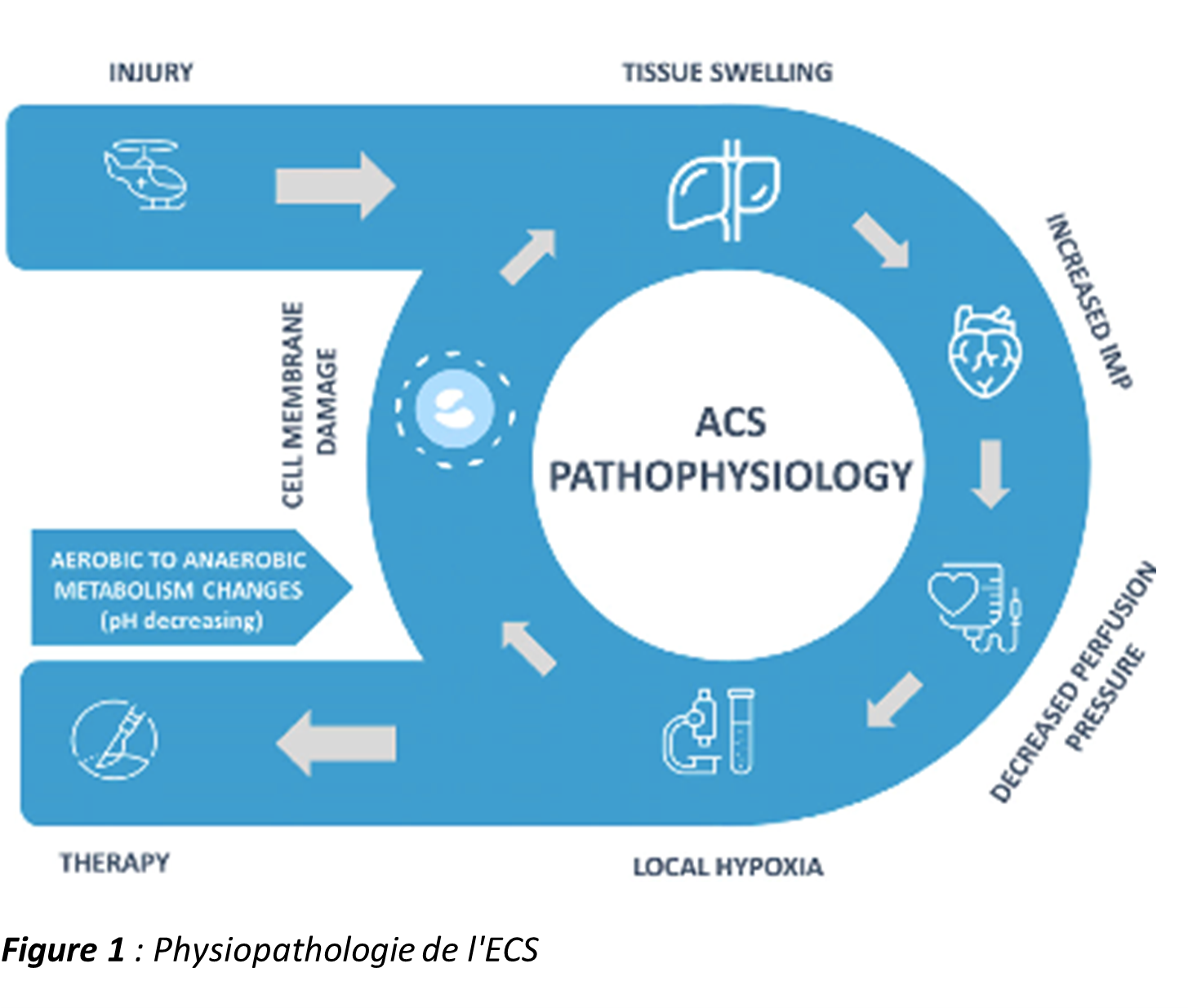
Le mécanisme physiopathologique exact de l’ECS continue d’être débattu, mais le développement général du syndrome est illustré dans la Figure 1.
Traitement et complications
La seule solution de traitement définitif à un ECS manifeste est une intervention chirurgicale appelée fasciotomie.
Même si la fasciotomie est la solution définitive au ECS diagnostiqué à un stade précoce, elle présente également des limites et des complications. Celles-ci comprennent la nécessité de suturer la plaie, des déformations esthétiques, de la douleur et des lésions nerveuses, une faiblesse musculaire permanente et une insuffisance veineuse chronique.
Une fasciotomie tardive peut toutefois entraîner des lésions plus graves sous la forme de déficits sensoriels du membre, d'orteils en griffe et peut même justifier une amputation. Des lésions permanentes peuvent déjà être présentes à l'apparition des symptômes. Il a été démontré que les fasciotomies réalisées plus de 8 heures après le diagnostic de l’ECS étaient associées à un risque d'infection significativement plus élevé. Aussi, les études animales montrent que les dommages cellulaires commencent environ 3 heures après un traumatisme ischémique complet et sont pratiquement terminés 6 heures après. Chez l’homme, le niveau de tolérance varie et les traumatismes ischémiques ne sont pas tous complets.
Il est donc généralement admis qu'il vaut mieux pratiquer une fasciotomie en aiguë qui s'avère finalement inutile que de pratiquer une fasciotomie tardive chez un patient symptomatique et de risquer les conséquences d'un ECS chronique.
Aussi, dans leur étude, Merchan et ses collègues (2022) nous indiquent qu’un risque accru d’infection est en corrélation direct avec de délai de fermeture de la plaie : les patients qui ont développé une infection ont eu une suture cutanée aux alentours du 7ème jour, alors que ceux qui n’en ont pas eu ont subi une fermeture aux alentours du 4ème jour.
Processus actuel de diagnostic du syndrome des loges
À l'heure actuelle, le diagnostic du ECS repose essentiellement sur les symptômes cliniques. Cette méthode exige que le patient soit disposé à coopérer. La seule méthode objective utilisée pour la détection du ECS est actuellement la mesure directe de l'IMP, mais les médecins ne mesurent généralement l'IMP que si les symptômes s'avèrent ambigus ou en tant qu'examen complémentaire pour faciliter le diagnostic.
Signes cliniques du syndrome des loges
-
Douleur (sensation de brûlure, profonde, reproduite lors de l’étirement passif)
-
Pâleur
-
Absence de pouls (si lésion artérielle, rare)
-
Paralysie (rare)
-
Paresthésies (diminution de la sensibilité fine ou du sens des vibrations)
L’œdème et la tension palpable d’une loge musculaire sont les premiers signes d’un ECS et sont des manifestations d’une augmentation de la tension musculaire. Toutefois, ces signes ne sont que des indicateurs grossiers d’une augmentation de l’IMP et d’autres signes doivent également être recherchés.
Ainsi, en combinant le test de palpation et la vérification de la présence d’un ou plusieurs de ces signes cliniques, on obtient une spécificité élevée mais une sensibilité faible.
Mesure de la pression intramusculaire
Lors du diagnostic de l’ECS, une méthode de mesure objective serait souvent utile pour établir le diagnostic. Le principal inconvénient de la mesure directe de l'IMP est son caractère invasif et les complications qui y sont associées. Elle peut également être influencée par une erreur de mesure subjective. Elle est le plus souvent utilisée chez les patients incapables de coopérer efficacement avec le médecin. De nombreux auteurs recommandent de mesurer l’IMP chez tous les patients souffrant de fractures et appartenant au groupe à risque de développer un ECS.
Grâce à la mesure de l’IMP, il est possible de détecter le développement d’un ECS avant l’apparition de symptômes. Cela permet une intervention précoce et améliore considérablement les chances de guérison.
Les seuils de l’IMP signalant un ECS varient selon les auteurs : Mubarak et al. (1978) suggèrent le seuil de 30 mmHg, tandis que Matsen et al. (1980) celui de 45 mmHg. Dans tous les cas, la valeur de l’IMP doit toujours être comparée à la valeur de la pression artérielle du patient.
Autres méthodes invasives de détection du syndrome des loges
Deux de ces méthodes utilisent l'analyse localisée des changements métaboliques dans le compartiment musculaire lésé : la surveillance du glucose et la surveillance du pH.
La surveillance du glucose dans le muscle a été étudiée dans un modèle canin, où elle a montré une sensibilité de 100 % et une spécificité de 75 %, et a permis une surveillance rapide des changements de l'activité métabolique.
Concernant la surveillance de pH intramusculaire, les premières études ont montré de meilleurs résultats que la mesure de l'IMP, avec une valeur de pH critique identifiée de 6,38, une sensibilité de 95 % et une spécificité de 80 % dans la détection du ECS.
Méthodes non-invasives
De nombreux travaux de recherche visent à trouver une méthode qui permettrait une surveillance continue à long terme de l'apparition de l’ECS. Comme il n'est pas possible de mesurer l'IMP de manière non invasive, d'autres méthodes ont été évaluées pour mesurer différents phénomènes pouvant être corrélés avec les valeurs de l'IMP ou fournir différentes informations sur les tissus de la loge qui sont également compromis dans l’ECS, comme le degré d'oxygénation.
-
La mesure quantitative de la dureté des tissus, qui est essentiellement un examen palpatoire quantifié
-
La mesure de l'oxygénation locale par réflexion du rayonnement dans la partie proche du spectre infrarouge - NIRS
-
L'utilisation de méthodes faisant appel à l’échographie (élastographie de contrainte SE ou élastographie par onde de cisaillement SWE)
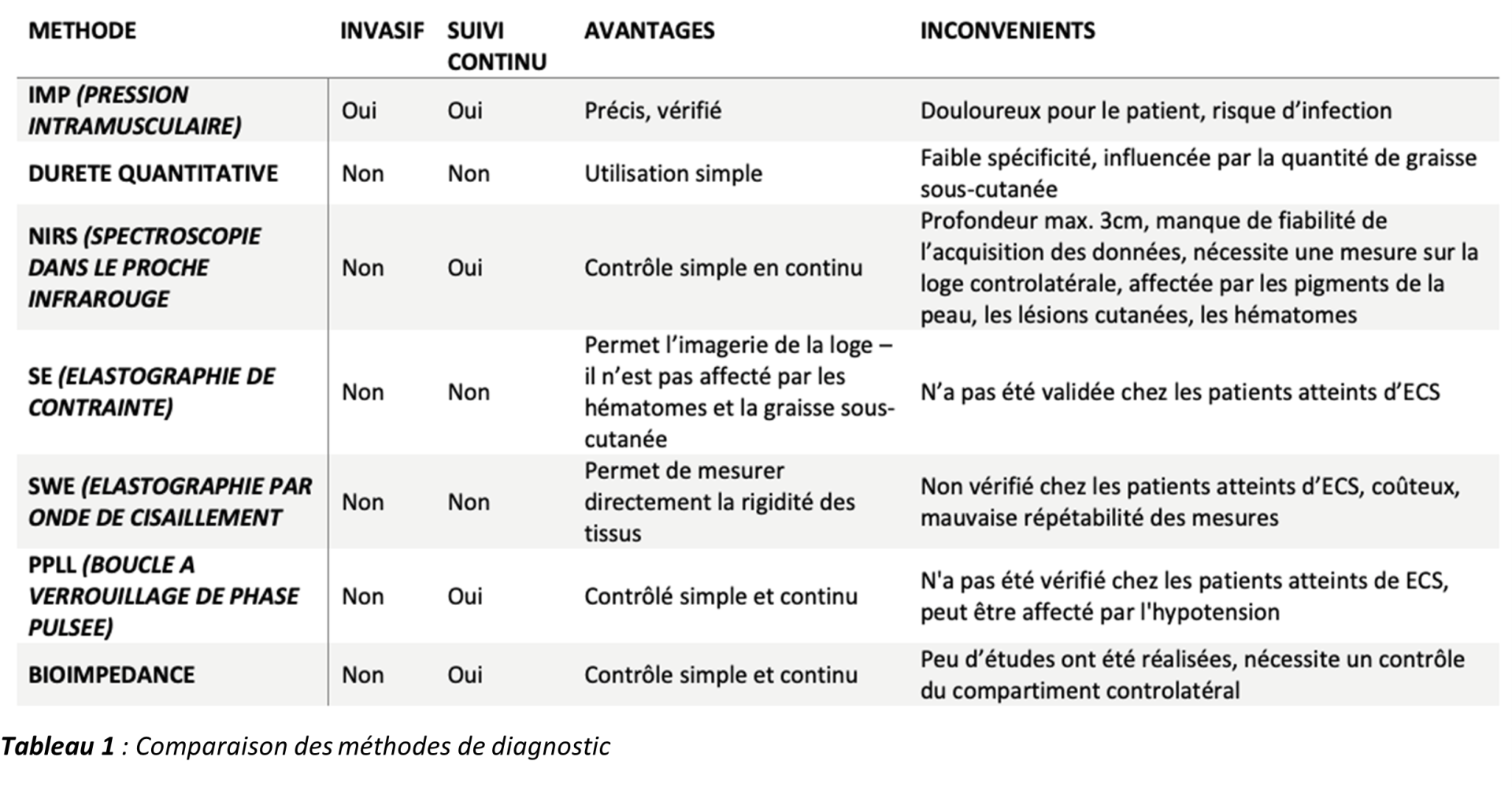
Les méthodes moins étudiées sont l'imagerie par résonance magnétique (IRM), la scintigraphie, la débitmétrie laser doppler et la bioimpédance. L’IRM a été utilisée avec un certain succès pour le diagnostic des ECS chroniques. Le Tableau 1 résume les avantages et les inconvénients de chacune de ces méthodes.
Conclusion
Actuellement, les médecins s'appuient sur un diagnostic basé uniquement sur les symptômes cliniques. Si les symptômes ne sont pas clairs, une mesure invasive de l'IMP peut être effectuée pour faciliter le diagnostic. Bien que cette méthode se soit avérée fiable, elle présente plusieurs inconvénients. Elle ne peut pas être utilisée pour une surveillance continue à long terme ; sa nature invasive comporte un risque d'infection et la mesure est douloureuse pour le patient.
Un moyen simple et non invasif de surveiller en permanence l'évolution de l’ECS permettrait d'améliorer considérablement la qualité des soins. La méthode qui s’en rapproche le plus est la NIRS. Elle a donné des résultats prometteurs et fait même l’objet d’essais cliniques à cette fin. Comme la NIRS fait l’objet d’études approfondies, on peut s’attendre à ce qu’elle devienne plus standardisée et disponible pour la pratique clinique.
La méthode la plus prometteuse pour la détection de l’ECS est probablement la méthode SE. Le principal avantage de cette méthode, par rapport à la SWE, est le prix de l’équipement. Ces deux méthodes fournissent plus d’informations sur la rigidité de la loge que la PPLL ou la simple échographie.
Référence article
Novak M, Penhaker M, Raska P, Pleva L and Schmidt M. Extremity compartment syndrome: A review with a focus on non-invasive methods of diagnosis. Front. Bioeng. Biotechnol. 10:801586 (2022). DOI: 10.3389/fbioe.2022.801586